个人简介
陈俊,91吃瓜 ,教授,博士生导师。中组部“海外高层次引进人才计划”青年项目获得者、广东省“珠江人才计划”青年拔尖人才、91吃瓜 “百人计划”中青年杰出人才、91吃瓜 “逸仙学者计划”优秀学者。2007年获得武汉大学学士学位,2013年于中国科学院生物物理研究所(中国科学院大学)获得博士学位, 2013年至2018年在加拿大蒙特利尔临床研究所(IRCM)从事博士后研究工作,2018年加入91吃瓜 。
已在Nature (2017)、Nature Cancer (2篇:2023, 2024;均为ESI高引论文)、Science Immunology (2025)、Science Advances (2025) 等一流期刊上发表多项重要成果。团队连续报道了多个巨噬细胞新靶点,提出了“靶向巨噬细胞重编程肿瘤免疫微环境 (ReTime) ”的新科学观点。目前已有多个原创靶点正在转化为 First in Class 的新药。已申请相关领域国际及中国专利多项。获得国家自然科学基金指南引导类原创探索计划“肿瘤免疫与肿瘤代谢”项目、国家自然科学基金面上项目、科技部国家重点研发项目(2项)、广东省自然科学基金卓越青年团队项目、基金广州市基础与应用基础研究项目、91吃瓜 青年教师重点培育项目、澳门科学技术发展基金等项目支持。
学科专业:免疫学
科研方向
恶性肿瘤是人类健康最大的杀手之一,给医疗系统造成极大的负担和损失。肿瘤免疫疗法是当前最有希望战胜癌症的方法,被Science杂志评为2013年的年度科学突破,并获得2018年诺贝尔医学或生理学奖。肿瘤免疫疗法通过阻断免疫细胞上的免疫检查点通路 (Immune Checkpoint Pathway) 促进或者恢复免疫细胞的抗肿瘤活性,重新激活病人自身的免疫系统对抗癌症。多种PD-1/PD-L1单克隆抗体新药陆续被批准用于肿瘤免疫治疗。这些全新的药物在临床上对一小部分癌症晚期病人取得了不错的疗效,但是,目前临床适应症仅仅包括非常有限的一部分非小细胞肺癌,黑色素瘤和淋巴瘤等,临床上平均响应率只有28%左右,对绝大多数“冷肿瘤”病人并没有效果。这些药物发挥疗效依赖于肿瘤组织中杀伤性CD8+ T 细胞(CTL)的浸润。但是,大多数“冷肿瘤”中T细胞浸润都较少,这是PD-1疗法对绝大多数“冷肿瘤”患者没有响应的主要原因之一。
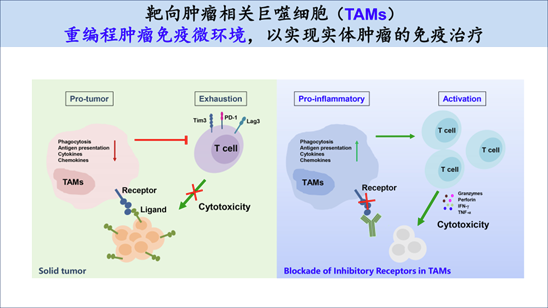
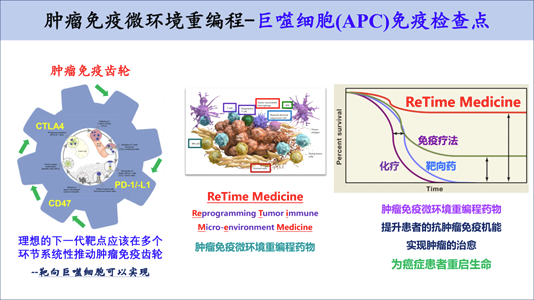
然而,肿瘤微环境中含有大量巨噬细胞,靶向巨噬细胞的肿瘤免疫疗法具有很大潜力。联合运用巨噬细胞疗法与T细胞免疫疗法将会是肿瘤免疫治疗最重要的方向之一。然而,目前我们对巨噬细胞在肿瘤微环境及抗肿瘤免疫中功能机制的理解非常欠缺,亟需进一步的深入研究。因此,当务之急在于寻找全新的巨噬细胞免疫检查点及探索抗肿瘤免疫的新机制,并且就此开发创新型的肿瘤免疫治疗药物,为新一代的多靶点、多方案联用的肿瘤免疫疗法提供创新靶点和药物前体。
目前,我们的工作聚焦于肿瘤免疫微环境的调节机制,肿瘤免疫治疗新靶点和新疗法的研究。主要方向包括:(1)CD47-SIRPα巨噬细胞检查点在肿瘤免疫治疗中的功能机制;(2)巨噬细胞上新型免疫检查点的发现及相关药物的研发;(3)肿瘤免疫微环境的研究。目前已有多个原创靶点正在转化为 First in Class 的新药。
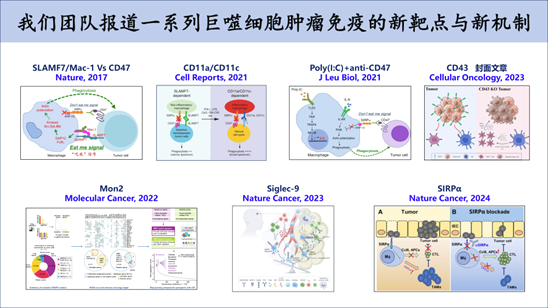
巨噬细胞CD47免疫检查点通路(“Don’t eat me”信号)是极有潜力的肿瘤免疫新靶点和研究热点。然而,巨噬细胞的吞噬受体和“Eat me”信号的机制一直没有被揭示,导致对CD47单抗疗法的分子机制、适应症、临床副作用等出现诸多错误理解和武断的商业化行为。我们在国际上率先鉴定了巨噬细胞的吞噬受体SLAMF7/Mac-1复合物和 “Eat me” 信号,揭示了巨噬细胞CD47阻断疗法介导的肿瘤免疫治疗的机制(Nature, 2017,唯一第一作者)。同时受邀在著名免疫学期刊Trend in Immunology (2018)上发表专题综述文章。我们的工作理性的解析了热门靶点CD47的分子机制,为该领域做出了显著贡献,相关机制被Immunity、Nature Nanotechnology验证,并被Nature Reviews Cancer总结为吞噬检查点领域的重要里程碑发现。我们提出CD47单抗对实体肿瘤不会有疗效,SLAMF7可以作为CD47单抗免疫治疗的诊断生物标志物,SLAMF7阳性的血液肿瘤(B细胞肿瘤和髓系肿瘤为主)会是CD47单抗的良好适应症。我们据此申请一项PCT专利,所预测的适应症被多项独立的临床试验验证(N Engl J Med. 2018.; J Clin Oncol. 2019)。
我们还发现炎性病理情况下的吞噬通路会发生改变,其效率依赖于CD11a/CD1c/CD8,为巨噬细胞功能失调引起的免疫性疾病提供了新的解释(Cell Reports, 2021, 共同通讯)。进一步的,我们发现了针对实体肿瘤治疗的CD47抗体药物的联用方案(J Leukocyte Biol, 2021, 最后通讯),并且获得了一项授权专利(授权专利:202010636864.8)。
新辅助免疫检查点阻断疗法仅使一小部分多形性胶质母细胞瘤(GBM)患者受益。因此,靶向髓系细胞上的其他免疫调节剂是一种颇具吸引力的治疗选择。我们对接受新辅助抗PD-1疗法的GBM患者进行了单细胞RNA测序和空间转录组学分析。我们鉴定出具有功能可塑性的独特单核细胞来源的肿瘤相关巨噬细胞亚群,这些亚群高度表达免疫抑制性基因SIGLEC9,且优先在抗PD-1治疗无应答者中积聚。在小鼠模型中,敲除SiglecE(SIGLEC9的鼠源同源基因)可显著抑制肿瘤发展并延长生存期。靶向SiglecE可通过抗原呈递、分泌趋化因子以及共刺激因子相互作用,直接激活CD4+ T细胞和CD8+ T细胞。此外,敲除SiglecE与抗PD-1/PD-L1治疗具有协同作用,可提高抗肿瘤疗效。我们的数据表明,Siglec-9是巨噬细胞上的一种新颖的免疫检查点分子,对其进行靶向干预有望增强抗PD-1/PD-L1疗法在GBM治疗中的疗效(Nature Cancer, 2023, 共同通讯,ESI高引论文)。
免疫抑制性髓系细胞会阻碍肿瘤免疫治疗的疗效,但其确切机制仍不明确。在此,通过对结直肠癌组织进行单细胞测序,我们发现与正常组织中的同类细胞相比,肿瘤相关巨噬细胞和MDSC数量增加最为显著,并且在所有免疫细胞中展现出最强的免疫抑制特征。这些细胞中,含免疫受体酪氨酸抑制基序的受体(包括SIRPA)的表达显著上调。值得注意的是,Sirpα基因敲除(Sirpα KO)小鼠相较于野生型小鼠,对肿瘤进展的抵抗能力更强。此外,Sirpα 缺失通过扩增具有强抗肿瘤活性的TAM_Ccl8hi和gMDSC_H2-Q10hi细胞亚群,对肿瘤微环境进行了重编程。Sirpα KO巨噬细胞表现出强大的吞噬和抗原呈递能力,从而增强T细胞的活化与增殖。此外,Sirpα KO巨噬细胞通过Syk/Btk依赖的Ccl8分泌,促进T细胞募集。因此,Sirpα缺失可增强固有免疫和适应性免疫激活,且不依赖于CD47的表达,阻断Sirpα可能是提高癌症免疫治疗疗效的一种有前景的策略(Nature Cancer, 2024, 共同通讯,ESI高引论文)。
肿瘤免疫微环境中髓系细胞与 T 细胞之间受限的相互作用,在很大程度上制约了癌症免疫疗法的疗效,而其潜在机制仍不明确。Parkin是参与线粒体质量控制的 E3 泛素连接酶,是免疫反应的调节因子。我们发现AMPK 激活Parkin通过自噬作用下调巨噬细胞 MHC-I的表达,导致肿瘤抗原呈递不足,削弱了抗肿瘤免疫反应。在Parkin基因敲除的小鼠上多种实体肿瘤进展减缓,小鼠生存期延长。通过单细胞测序和流式细胞术,我们证明Parkin KO能够通过激活先天性免疫和适应性免疫来重塑肿瘤免疫微环境,从而控制肿瘤进展与复发。因此,靶向Parkin可以增强巨噬细胞向T细胞呈递肿瘤抗原,激活免疫反应,抑制肿瘤进展。此外,靶向Parkin与免疫检查点阻断(ICB)疗法具有协同作用。我们的研究结果揭示了Parkin作为巨噬细胞抗原呈递抑制因子的新作用,其可协调巨噬细胞与T细胞之间的相互作用(Science Advances,2025,最后通讯)。
另外,我们还报道了CD43分子调控结直肠癌的免疫微环境(Cellular Oncology, 2023, 封面文章, 最后通讯;授权专利:202211634552.9),Mon2调节乳腺癌免疫治疗的功能机制(Molecular Cancer, 2022, 共同通讯)和HVEM分子调控急性淋巴性白血病免疫逃逸的机制(Cellular Oncology, 2024, 共同通讯)。
学术论著
1. Zhong C, et al. Science Immunology, 2025, 出版中,(通讯作者) (IF=17.6)
2. Wang XY, et al. AMPK-dependent Parkin activation suppresses macrophage antigen presentation to promote tumor progression. Science Advances 2025; 11, eadn8402. (通讯作者) (IF=13.2)
3. Liu, YJ., et al. HVEM in acute lymphocytic leukemia facilitates tumor immune escape by inhibiting CD8+ T cell function. Cellular Oncology 2024; 47, 1779–1796. (通讯作者)
4. Xie, Z, et al. Targeting macrophages to reprogram the tumor immune microenvironment. Blood Science 2024; 6(4): p e00203, DOI: 10.1097/BS9.0000000000000203. (Invited
Review)(通讯作者)
5. Huang, C., et al. Targeting tumor associated macrophages (TAMs) reprograms tumor immune microenvironment to promote solid tumor immunotherapy. Cellular Oncology 47, 2011–2014 (2024). (通讯作者)
6. Huang C., et al. Sirpα on tumor-associated myeloid cellsrestrains antitumor immunity in colorectal cancer independent of its interaction with CD47.Nature Cancer 2024; 5,500–516. (通讯作者) (IF=23.5)(ESI高引论文)
7. Mei, Y., et al.Siglec-9 acts as an immune-checkpoint molecule on macrophages in glioblastoma, restricting T-cell priming and immunotherapy response. Nature Cancer 2023; 4, 1273–129. (通讯作者) (IF=23.5)(ESI高引论文)
8. Wang XM., Chen J., and Jia GS. From dichotomy to diversity: deciphering the multifaceted roles of tumor-associated macrophages in cancer progression and therapy. Cancer Biology & Medicine 2023; 20230370; DOI: //doi.org/10.20892/j.issn.2095-3941.2023.0370. (通讯作者)
9. Zhao ZN., et al. A Nanobody–Bioorthogonal Catalyst Conjugate Triggers Spatially Confined Prodrug Activation for Combinational Chemo-immunotherapy. Journal of Medical Chemistry 2023; 66, 17, 11951–11964. (通讯作者)
10. Feng YY., et al. SIRPα: A key player in innate immunity. European Journal of Immunology 2023; 53:2350375. (Invited Review) (通讯作者)
11. Li Yy., et al. Targeting CD43 optimizes cancer immunotherapy through reinvigorating antitumor immune response in colorectal cancer. Cellular Oncology 2023; 46: 777–791 (封面文章) (通讯作者)
12. Li Y., et al. Integrative analysis of CRISPR screening data uncovers new opportunities for optimizing cancer immunotherapy. Molecular Cancer 2022; 21:2. (通讯作者) (IF=27.7)
13. Mao C., et al. Pan-cancer Analysis of GALNTs Expression Identifies a Prognostic of GALNTs Feature in Low Grade Glioma. Journal of Leukocyte Biology.2022; 112:887-899. (通讯作者)
14. Tang Z., et al. Inflammatory macrophages exploit unconventional pro-phagocytic integrins for phagocytosis and anti-tumor immunity. Cell Reports. 2021. 37, 110111. (通讯作者) (IF=9.99)
15. Zhong, C. et al. Poly(I:C) enhances the efficacy of phagocytosis checkpoint blockade immunotherapy by inducing IL-6 production. Journal of Leukocyte Biology2021; 110:1197–1208. (通讯作者)
16. Zhong C., Chen, J.# CAR-T cells engineering with CCR6 exhibit superior anti-tumor efficacy. Science Bulletin. 2021; 66:755–756. (通讯作者) (IF=18.8)
17. Chen J., et al. SLAMF7 is critical for phagocytosis of haematopoietic tumour cells via Mac-1 integrin. Nature. 2017; 544, 493-497. (唯一第一作者) (IF=50.5)
18. Veillette A# and Chen J. SIRPα–CD47 Immune Checkpoint Blockade in Anticancer Therapy. Trends in Immunology. 2018; 39(3):173-184. (IF=15.9)
19. Chen J. et al. The Endoplasmic Reticulum Adaptor Protein ERAdP Initiates NK Cell Activation via the Ubc13-Mediated NF-kB Pathway. The Journal of Immunology. 2015; 194,1292-1303. (第一作者)
20. Guo Y, et al. Valosin-containing protein cleavage by granzyme K accelerates an endoplasmic reticulum stress leading to caspase-independent cytotoxicity of target tumor cells. Journal of Immunology. 2010; 185(9): 5348-5359. (共同第一作者)
科研项目
1.中组部“海外高层次引进人才”青年项目,2018-2021,主持。
2. 91吃瓜 “百人计划”项目,2018-2023, 主持。
3. 国家重点研发项目-1,2019-2023,课题骨干,参与。
4. 91吃瓜 青年教师重点培育项目,2019-2020,主持。
5. 广州市基础与应用基础研究项目,2020-2023,主持。
6. 广东省“珠江人才计划”青年拔尖人才,2020-2025,主持。
7. 澳门科学技术发展基金,2020-2023,参与。
8. 2020年基因功能与调控教育部重点实验室开放研究基金,2020-2021。
9. 2020年国自然面上项目,2021-2024,主持。
10. 国家重点研发项目-2,2021-2025,课题负责人。
11. 2022年国自然指南引导类原创探索计划—“肿瘤免疫与肿瘤代谢”项目,2022-2024,主持。
12. 2024年度广东省自然科学基金卓越青年团队项目,2024-2027,核心成员。
学术兼职
广东省免疫学会副理事长及青委会主委
国际期刊 Cellular Oncology 杂志(中科院一区)副主编
中国免疫学会青工委常务委员
中国细胞生物学学会免疫细胞生物学分会理事
中国病理生理学会免疫专委会理事及青委会副主委
中国抗癌协会肿瘤生物治疗专业委员会委员
中国生理学会血液生理学专委会委员
中国生物物理学会肿瘤免疫分会常务委员




